Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Video ini menjelaskan tentang konsep larutan elektrolit dan non elektrolit yang dilengkapi dengan contoh-contoh soal dan aplikasi dalam kehidupan sehari-hari.

Memahami Larutan Elektrolit dan Nonelektrolit beserta Contohnya Kimia Kelas 10
NaCl (s) → Na+ (aq) + Cl− (aq) Perlu elo ingat bahwa larutan elektrolit kuat selalu terdiri dari asam kuat, basa kuat dan garam. Nah, larutan NaCl (garam) bukan satu-satunya yang tergolong ke dalam larutan elektrolit kuat. Karena terdapat beberapa larutan yang dapat menghantarkan arus listrik adalah NaOH (soda api), H2SO4 (asam sulfat), HCl.

Materi Kimia Elektrolit dan Non Elektrolit YouTube
Berikut adalah manfaat larutan non elektrolit. 1. Sebagai sumber energi. Gula adalah salah satu komponen larutan non elektrolit. Gula ini merupakan sumber energi dalam bentuk karbohidrat sederhana. Ketika tubuh manusia kekurangan gula, maka akan terasa lelah, jantung berdebar, dan sulit berkonsentrasi.

Larutan Elektrolit dan Non Elektrolit (Kimia SBMPTN, UN, SMA) YouTube
Jumlah partikel larutan elektrolit lebih banyak daripada larutan non-elektrolit sehingga sifat koligatifnya pun akan lebih besar. Nilai dari sifat koligatif larutan non-elektrolit dapat diketahui dengan rumus-rumus berikut ini: Penurunan tekanan uap. ΔP = P⁰.
Larutan Elektrolit dan Non Elektrolit
Contoh Larutan Non Elektrolit. Larutan selain asam, basa, dan garam, contoh: gula, alkohol, glukosa, urea, dll. Baca Juga : Benzena dan turunannya serta Penjelasannya. Demikian artikel mengenai Larutan ELektrolit dan Non Elektrolit Serta Penjelasannya. Semoga artikel ini dapat bermanfaat dan menambah wawasan anda mengenai pelajaran Ilmu.

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Larutan Elektrolit dan Non-Elektrolit: Sejarah Penemuan Larutan Elektrolit dan Non-Elektrolit. Penemuan larutan elektrolit dan non-elektrolit ternyata berhubungan dengan ilmuwan asal Swedia, Svante August Arrhenius (1859-1927). Kala itu ia tengah melakukan presentasi disertasi untuk gelar PhD-nya di Universitas Uppsala tahun 1884.

Larutan Elektrolit dan Nonelektrolit
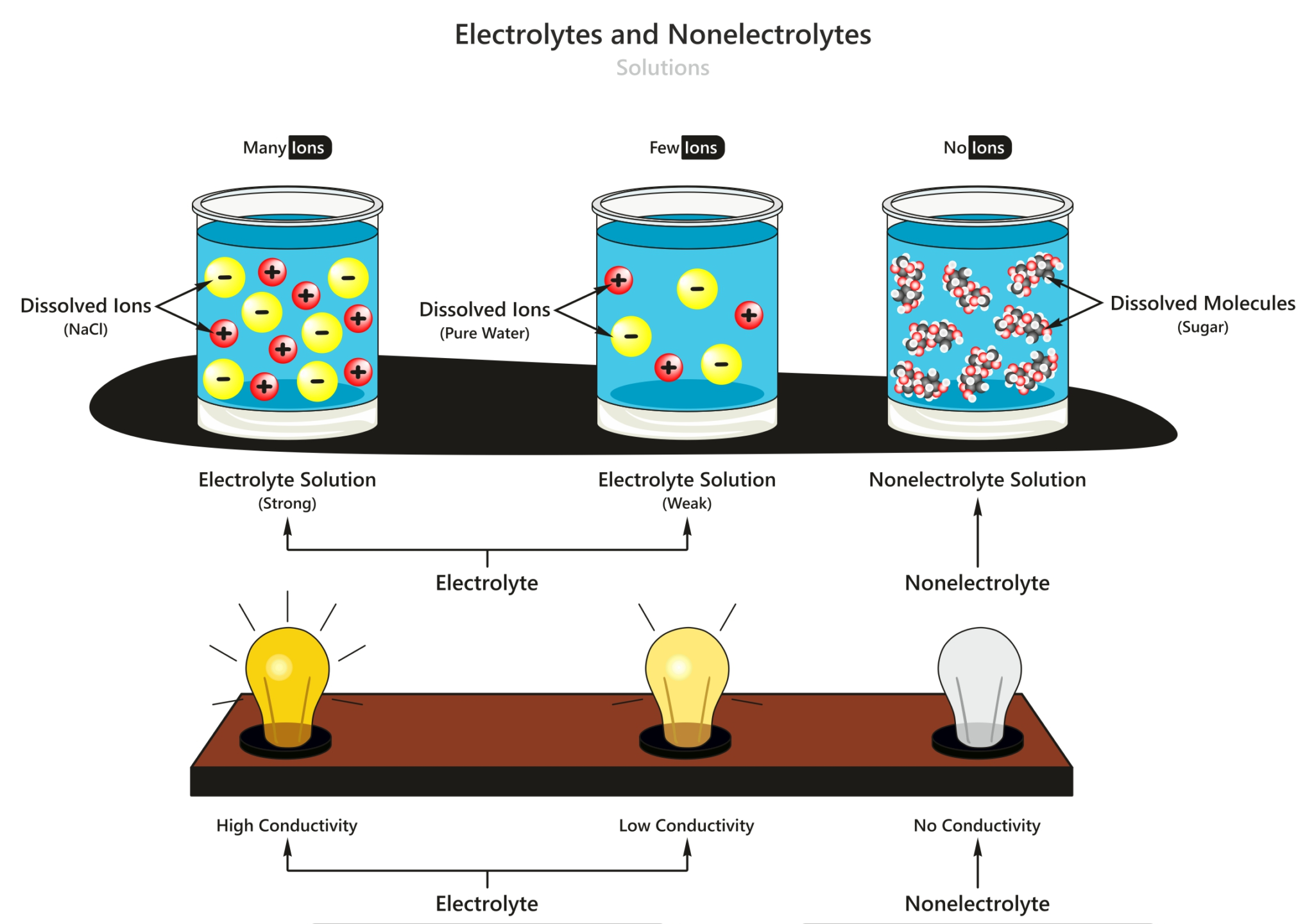
Pada larutan non elektrolit, zat non elektrolit yang terlarut tidak dapat terurai menjadi ion-ion, sehingga tidak terdapat ion-ion bebas yang dapat menghantarkan arus listrik. Sebagai contoh, larutan gula sukrosa (C 12 H 22 O 11 ) merupakan larutan non elektrolit.

SifatSifat Larutan Elektrolit dan Nonelektrolit Memotivasi Diri
Larutan elektrolit dapat memecah menjadi ion-ion saat larut dalam air dan dapat menghantarkan arus listrik, sedangkan larutan non-elektrolit tidak dapat membentuk ion-ion dan tidak menghantarkan arus listrik. Perbedaan ini bergantung pada jenis zat yang terlarut dalam larutan serta tingkat kelarutan zat tersebut.

Larutan Elektrolit dan Non Elektrolit
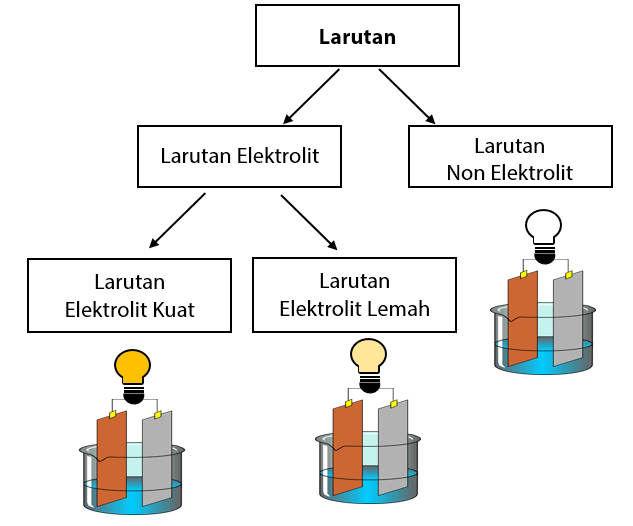
A. Perbedaan Larutan Berdasarkan Daya Hantar Listrik. Berdasarkan daya hantar listriknya, larutan terbagi menjadi 2 golongan yaitu larutan elektrolit dan larutan non elektrolit. 1. LARUTAN ELEKTROLIT. Larutan yang dapat menghantarkan listrik karena mengalami proses ionisasi (terurai menjadi ion positif dan negatif).

30 Contoh Larutan Elektrolit dan Non Elektrolit
Perbedaan Larutan Elektrolit dan Non Elektrolit Masmiani dalam uraian "Larutan Elektrolit, Larutan Non Elektrolit, dan Asam Basa" menyatakan bahwa larutan elektrolit mengandung partikel bermuatan kation dan anion. Jika larutan elektrolit dialirkan listrik (elektron), akan terjadi suatu proses yang dinamakan elektrolisis.

PPT ** Tugas bahan ajar Kimia** PowerPoint Presentation, free download ID5411227
Singkatnya, berikut perbedaan antara larutan elektrolit dan non elektrolit: 1. Kemampuan menghantarkan listrik. Larutan elektrolit mampu menghantarkan listrik baik itu kuat maupun lemah atau mudahnya larutan elektrolit berperan sebagai konduktor. Sedangkan larutan non elektrolit tidak dapat menghantarkan listrik atau dapat disebut sebagai isolator.

Larutan Elektrolit dan Reaksi Redoks Kelas 10 • Part 1 Larutan Elektrolit dan Nonelektrolit
Contoh Larutan Elektrolit dan Nonelektrolit. Kami akan memberikan beberapa contoh konkret dari masing-masing tipe larutan untuk lebih menggambarkan perbedaannya. Larutan Asam Klorida (HCl): Ketika HCl larut dalam air, ia terdisosiasi menjadi ion hidrogen (H⁺) dan ion klorida (Cl⁻), sehingga menjadi larutan elektrolit kuat. Larutan Natrium.

Larutan Elektrolit dan Non Elektrolit (Kompone
Larutan elektrolit yang memberikan gejala berupa lampu menyala dan membentuk gelembung gas disebut elektrolit kuat. Contohnya yaitu HCl, air aki, air laut, dan air kapur. Adapun elektrolit yang tidak memberikan gejala lampu menyala tetapi menimbulkan gelembung gas termasuk elektrolit lemah. Contohnya yaitu larutan amonia, larutan cuka,dan.

Contoh Larutan Elektrolit Kuat Dan Lemah Berbagai Contoh
Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah memiliki derajat ionisasi jauh dibawah 1, berarti zat terlarut yang berubah menjadi ion hanya sedikit. Hal ini menyebabkan larutan elektrolit lemah menghantarkan listrik dengan kurang baik.

LARUTAN ELEKTROLIT DAN NONELEKTROLIT ( KIMIA SMA KELAS 10 ) YouTube
Sobat Pijar, itulah wawasan tentang larutan elektrolit dan larutan non elektrolit. Semoga penjelasan tadi dapat membantumu memahami perbedaan keduanya dan memberikan gambaran lebih jelas tentang sifat-sifat unik yang dimiliki oleh masing-masing jenis larutan, ya! Gimana, semakin tertarik belajar Larutan Elektrolit dan Non Elektrolit lebih lanjut?

Larutan Elektrolit dan Non Elektrolit, Ini Contoh dan Perbedaannya!
Zat yang tergolong non elektrolit biasanya dimiliki oleh larutan alkohol (C 2 H 5 OH, C 3 H 7 OH) larutan gula (C 6 H 12 O 6), larutan urea (CO(NH 2) 2, dan lain-lain. Jadi, secara singkat perbedaan larutan elektrolit dan non elektrolit bisa kamu lihat pada tabel di bawah ini ya!